2023年3月8日,浙江时迈药业有限公司EGFR×CD3双抗SMET12联合特瑞普利单抗获NMPA批准临床,用于治疗EGFR阳性晚期/转移性实体瘤,此为时迈药业获得的第7个临床批件,研发进度全球领跑。 
SMET12是时迈药业基于自主开发的抗体筛选文库和完全自主知识产权的双抗平台,构建的肿瘤细胞靶点+免疫细胞靶点组合的全人源双抗药物,为全球首款可直接静脉滴注的EGFR×CD3双抗,于2021年底前分别获批中美两地临床研究。 SMET12具有EGFR×CD3双抗分子独特的作用机制,能够通过共结合EGFR阳性肿瘤细胞和CD3阳性T细胞诱导T细胞活化和增殖,释放干扰素γ(IFN-γ)、肿瘤坏死因子-α(TNF-α)、Granzyme B等细胞因子杀伤肿瘤细胞。因此,SMET12可以克服传统化疗药、EGFR小分子抑制剂、EGFR单抗、ADC等靶向药物的耐药问题。并且对EGFR通路耐药突变或旁路激活导致耐药的患者仍然有效,临床上解决耐药后无药可用、疾病进展快的问题,并且该双抗为调动自身免疫系统进行肿瘤细胞杀伤的免疫调节类药物,一旦起效,临床上有望彻底治愈肿瘤患者。 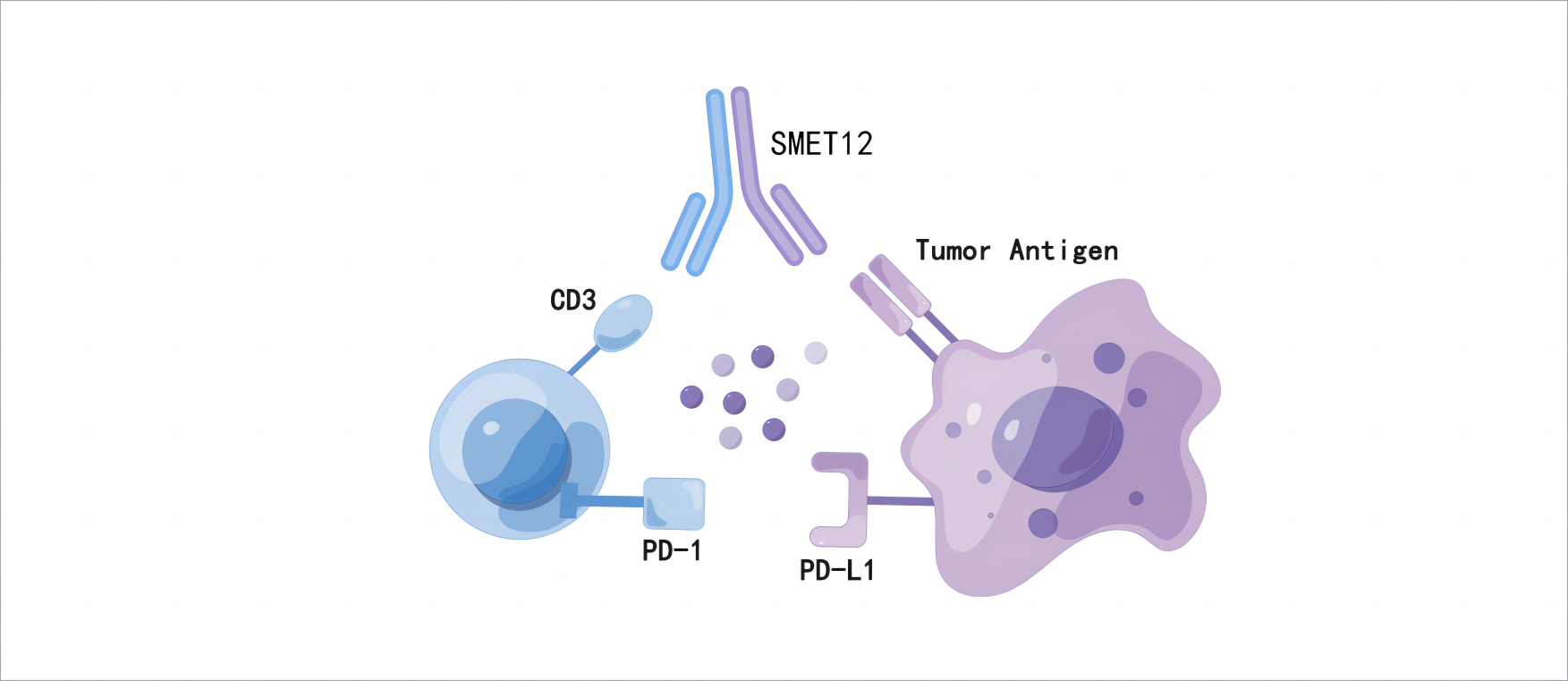
△ SMET12单药作用机制 目前时迈药业SMET12单药项目已完成全部剂量爬坡、进入临床II期,耐受性良好,安全可控。初步疗效显示,入组受试者完成DLT观察后均接受持续的研究药物给药,定期随访完成肿瘤评估,最长在组治疗时间已超250天,多例患者出现持续的肿瘤缩小和疾病控制,展现出良好的抗肿瘤活性。 截至目前,全球已有数十款在研靶向CD3的双特异性抗体,其中十余款CD3双抗都进行了与PD-1抗体的联合用药研究,如Cibisatamab、Orlotamab、MGD007、Tebetafusp、Blinatumomab等,目前处于临床早期研究阶段,均尚未获批与PD-1抗体联用的肿瘤适应症。目前国内尚无在研的CD3双抗药物与PD-(L)1抗体进行联用临床研究的报道,多处于临床研发早期或临床前研究阶段。 SMET12联用PD-1特瑞普利单抗针对肺癌、胃癌、卵巢癌、食管癌等适应症体外药效学模型研究显示,可以在大幅度降低剂量的条件下产生显著抗肿瘤作用,对比两者单独使用具有更强大的药效功能。小鼠体内移植瘤模型上同样证实SMET12联用特瑞普利单抗相比于单独使用具有更强的抗肿瘤功能。这些药效学研究显示SMET12联用特瑞普利单抗可以有效解除T细胞激活后表达PD-1等抑制性受体而产生的免疫抑制环境,进一步发挥SMET12的抗肿瘤功能,达到协同增效的作用,对实体瘤的治疗具有潜在良好的治疗前景,优势明显。 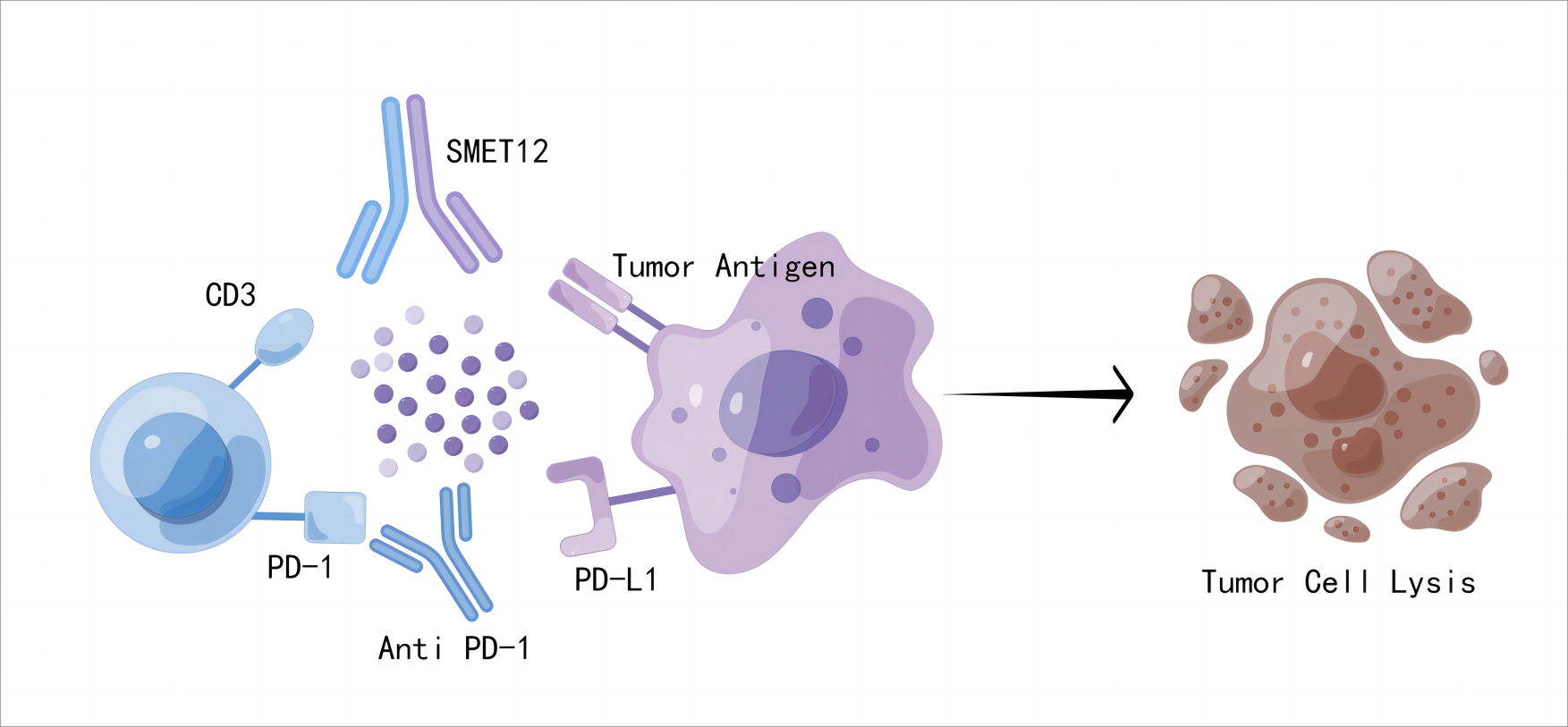
△ SMET12联用PD-1特瑞普利单抗作用机制
总结 基于SMET12与PD-1特瑞普利单抗联用增效的体内外药效结果以及SMET12单药临床有效性及安全性数据,SMET12联合PD-1特瑞普利单抗将是颇具新颖性的候选治疗方法。目前仍然存在大量未满足的临床治疗需求,此联合用药的开发成功可能为实体瘤的治疗提供一种有效的治疗选择。为评价SMET12联合特瑞普利单抗在人体内的安全性、耐受性、药代动力学特征以及初步治疗的疗效,拟在EGFR阳性实体瘤患者中,开展SMET12联合特瑞普利单抗剂量递增和扩增试验,为后期临床开发提供依据。 疗效是检验创新药的试金石,时迈药业坚持以满足临床需求为导向,本次SMET12联合治疗临床试验研究的成功获批,是又一里程碑事件,反向验证时迈药业自主知识产权的双抗平台价值。 |